2011년02월27일 13번
[자연과학개론] 다음은 계수를 맞추지 않은 프로페인(C3H8)의 연소 반응식이다.
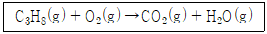
273℃, 1 atm에서 0.2 mol의 프로페인을 완전히 연소시키기 위해 필요한 산소의 최소 부피는? (단, 산소는 이상 기체 방정식을 따르고, 0℃에서 RT = 22.4 Lㆍatm/mol이다.)
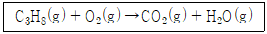
273℃, 1 atm에서 0.2 mol의 프로페인을 완전히 연소시키기 위해 필요한 산소의 최소 부피는? (단, 산소는 이상 기체 방정식을 따르고, 0℃에서 RT = 22.4 Lㆍatm/mol이다.)
- ① 11.2 L
- ② 22.4 L
- ③ 33.6 L
- ④ 44.8 L
- 56.0 L
(정답률: 알수없음)
문제 해설
반응식을 계수를 맞춘 상태로 쓰면 다음과 같다.
C3H8 + 5O2 → 3CO2 + 4H2O
프로페인 0.2 mol이 연소할 때 생성되는 이산화탄소와 수증기의 몰 수는 각각 0.6 mol과 0.8 mol이다. 이때 필요한 산소의 몰 수는 이들 몰 수의 합인 1.4 mol이다.
이상 기체 방정식을 이용하여 산소의 부피를 계산하면 다음과 같다.
PV = nRT
V = nRT/P = (1.4 mol) × (22.4 Lㆍatm/mol) / (1 atm) = 31.36 L
따라서, 0.2 mol의 프로페인을 완전히 연소시키기 위해 필요한 산소의 최소 부피는 31.36 L이다. 하지만 보기에서는 이 값과 다른 값들이 주어져 있으므로, 이 중에서 적절한 값을 선택해야 한다.
이 문제에서는 산소의 몰 수가 1.4 mol이므로, 이를 0.2 mol로 나누어 보면 다음과 같다.
1.4 mol O2 : 0.2 mol C3H8
이 비율을 이용하여 산소의 부피를 구하면 다음과 같다.
1.4 mol O2 → 44.8 L (이상 기체 방정식)
0.2 mol C3H8 → 필요한 산소의 몰 수
따라서, 필요한 산소의 최소 부피는 44.8 L이다.
C3H8 + 5O2 → 3CO2 + 4H2O
프로페인 0.2 mol이 연소할 때 생성되는 이산화탄소와 수증기의 몰 수는 각각 0.6 mol과 0.8 mol이다. 이때 필요한 산소의 몰 수는 이들 몰 수의 합인 1.4 mol이다.
이상 기체 방정식을 이용하여 산소의 부피를 계산하면 다음과 같다.
PV = nRT
V = nRT/P = (1.4 mol) × (22.4 Lㆍatm/mol) / (1 atm) = 31.36 L
따라서, 0.2 mol의 프로페인을 완전히 연소시키기 위해 필요한 산소의 최소 부피는 31.36 L이다. 하지만 보기에서는 이 값과 다른 값들이 주어져 있으므로, 이 중에서 적절한 값을 선택해야 한다.
이 문제에서는 산소의 몰 수가 1.4 mol이므로, 이를 0.2 mol로 나누어 보면 다음과 같다.
1.4 mol O2 : 0.2 mol C3H8
이 비율을 이용하여 산소의 부피를 구하면 다음과 같다.
1.4 mol O2 → 44.8 L (이상 기체 방정식)
0.2 mol C3H8 → 필요한 산소의 몰 수
따라서, 필요한 산소의 최소 부피는 44.8 L이다.



